有効性
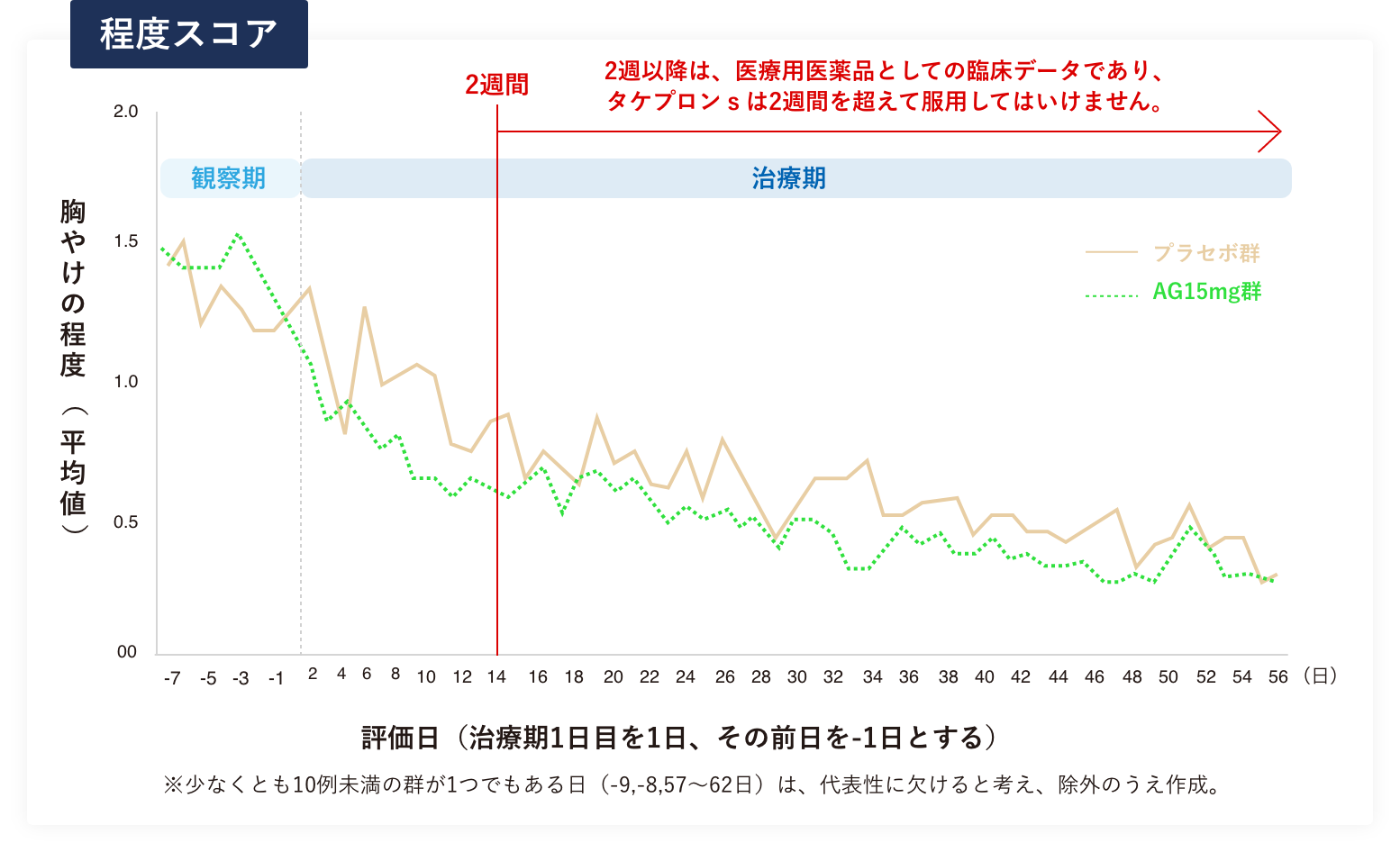
各日別の胸やけの程度(平均値)の推移
治療期2週時までの間、プラセボ(偽薬)群の胸やけの程度(平均値)が乱高下したのに対して、AG15mg(ランソプラゾール1回15mg)群では胸やけの程度(平均値)が速やかに軽減し安定しました。
治療期2週時以降についてもAG15mg群の胸やけの程度(平均値)はプラセボ群に対してほとんどの時点で低くなりました※3。
- ※3 タケプロンsでは、2週間を超えて続けて服用しないこととしております。治療期2週時以降のデータは、あくまでも医療用医薬品でのデータとなります。
- AG15mg群:ランソプラゾール1回15mg、1日1回(n=69)
- プラセボ群(n=72)
プラセボ群を含むいずれの投与群とも治療期(1~56日)における胸やけの程度(平均値)は、観察期(-7~-1日)に比べて減少した。治療期2週時までの間、プラセボ群の胸やけの程度(平均値)が乱高下したのに対して、AG15mg群では胸やけの程度(平均値)が速やかに軽減し安定した。治療期2週時以降についてもほとんどの時点で、AG15mg群の胸やけの程度(平均値)は低値であった。
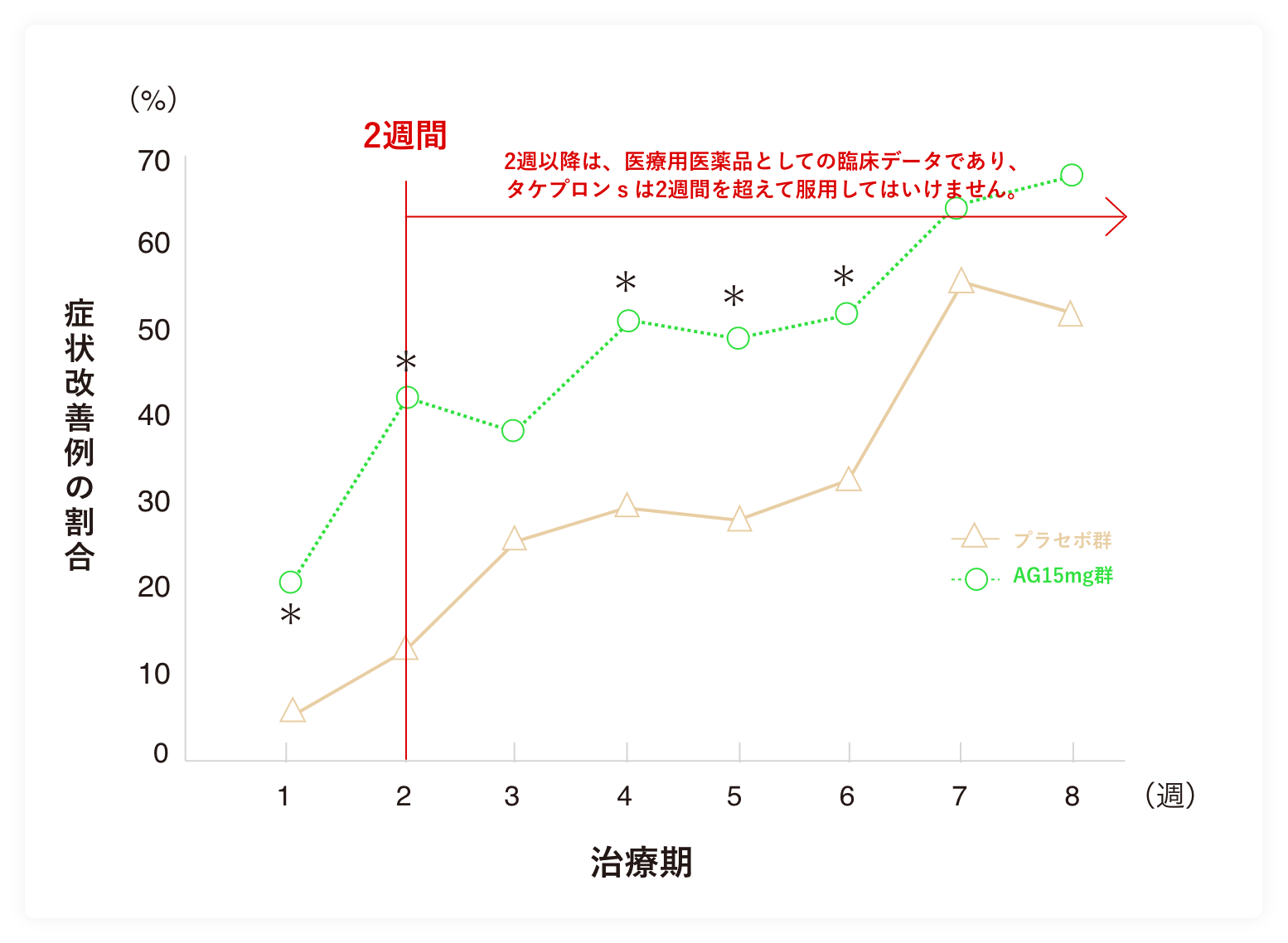
1週ごとの症状改善例の割合
プラセボ(偽薬)群は症状改善例の割合が30%を超えたのは治療期6週時でしたが、 AG15mg(ランソプラゾール1回15mg)群は、治療期2週時で30%を超えました。
AG15mg群の1週ごとの胸やけ症状の改善は、治療期3週時を除き、治療期1週時から6週時まで有意な差がみられました。
| 投与群 | 治療期 | |||||||
|---|---|---|---|---|---|---|---|---|
| 1週 | 2週 | 3週 | 4週 | 5週 | 6週 | 7週 | 8週 | |
| プラセボ群 | 5.6(4/72) | 12.5(9/72) | 25.7(18/70) | 29.0(20/69) | 27.9(19/68) | 32.4(22/68) | 55.9(38/68) | 51.5(35/68) |
| AG15mg群 | 18.8(13/69) | 42.0(29/69) | 38.2(26/68) | 50.0(33/66) | 49.2(32/65) | 51.6(33/64) | 64.1(41/64) | 67.2(43/64) |
数字は%、( )内は例数
AG15mg群:ランソプラゾール1回15mg、1日1回
*:AG15mg群 vs プラセボ群(分割表 X2検定:p≦0.05)
解析対象集団:最大の解析対象集団
「1週間あたり2日以上の頻度の胸やけ」の改善について経時的な推移をみるために、「1週間あたり2日以上の頻度で胸やけがみられなかった患者」、すなわち1週ごとの症状改善例の割合を算出した。
プラセボ群は治療期6週時で30%を超えたのに対して、AG15mg群は、治療期2週時で40%を超えた。AG15mgの1週ごとの胸やけ症状の改善は、治療期3週時を除き、治療期1週時から6週時まで有意な差がみられた。以上の結果より、本品はプラセボと比較して速やかに胸やけ症状を改善することが示された。
安全性
- 医療用医薬品ランソプラゾールによる、投与期間8週間までのデータを⽰しています。本剤タケプロンsはランソプラゾール15mg製剤であり、2週間を超えて続けて服⽤しないこととしております。
治療期に発生した有害事象
治験薬との因果関係が否定できない有害事象の発現頻度は、プラセボ(偽薬)群2.8%(2/72例)、AG15mg(ランソプラゾール1回15mg)群8.6%(6/70例)でプラセボ群に比べて発現頻度がやや高かったが有意な差はみられなかった。
治験薬との因果関係が否定できない自他覚的随伴症状は、プラセボ群1.4%(1/72例)、AG15㎎群1.4%(1/70例)で有意な差はみられなかった。また、治験薬との因果関係が否定できない臨床検査値異常変動の発現頻度は、プラセボ群1.4%(1/72例)、AG15㎎群7.1%(5/70例)でプラセボ群に比べて発現頻度がやや高かったが有意な差はみられなかった。
治験薬との因果関係が否定できない自他覚的随伴症状の発現頻度は、プラセボ群では「下痢NOS」1.4%(1/72例)、AG15mg群では「腹痛NOS」、「下痢NOS」、「嘔吐NOS」がいずれも1.4%(1/70例)であり、特に発現頻度が高い症状は認められなかった。
- NOS:「not otherwise specified」の略で、「他に分類されない」ことを示す。
- 随伴症状:副作用に通常随伴する症状のこと。
治験薬との因果関係が否定できない臨床検査値異常変動の発現頻度は、プラセボ群では「血中尿酸増加」1.4%(1/72例)、AG15mg群では「血中トリグリセリド増加」2.9%(2/70例)、「血中コレステロール増加」、「血中乳酸脱水素酵素増加」、「血小板数減少」、「白血球数減少」がそれぞれ1.4%(1/70例)であり、特に発現頻度が高い項目はなかった。
重篤な有害事象
AG15mg(ランソプラゾール1回15mg)群において重篤な有害事象の発現はなかった。

